(新加坡20日訊)一款由新加坡注資和參與研發的冠病疫苗,已經完成對580名美國和獅城受試者的第二期臨床試驗,九成在注射一劑疫苗的28天後產生了抗體,免疫T細胞也比其他信使核糖核酸疫苗高出8倍至16倍。公司準備在高風險地區開展第三期臨床試驗,並備產1000萬劑疫苗,預計年底獲緊急批準後就可投放市場。
美國生物科技公司Arcturus Therapeutics總裁兼首席執行官約瑟夫·佩恩(Joseph Payne)通過越洋視訊訪問時,介紹這款名為ARCT-021疫苗的最新進度。
他說,第二期臨床試驗有106人來自新加坡,他們從未感染冠病。第二期結果顯示,疫苗安全性和效能和第一期相似,注射一劑5微克疫苗的28天後,大多數受試者都能測出抗體。
比其他mRNA疫苗高出8倍至16倍
ARCT-021疫苗由這家納斯達克上市公司和杜克—新加坡國立大學醫學院合作研發,並獲新加坡經濟發展局4500萬美元(約1.8億令吉)資助。
他說:“根據杜克—國大醫學院研究,比起輝瑞(Pfizer-BioNTech)和莫德納(Moderna)的信使核糖核酸(mRNA)疫苗,ARCT-021疫苗有自我複製的能力,注射者體內免疫T細胞比其他mRNA疫苗高出8倍至16倍。這項技術也能比較準確地模擬病毒的入侵,因此讓注射者有更強的免疫反應。”
至於更強的T細胞反應是否能提供更強烈或是更持久的保護,甚至能對抗變種毒株,公司還在研究。佩恩也解釋,mRNA技術的好處是這種基因組成部分可以人造,可根據變種毒株調整mRNA的基因表達,從而達到刺激人體對變種毒株產生反應的效果。
由於美國的接種已上軌道,公司得另找病毒仍然肆虐的國家展開第三期臨床試驗,這樣才能在接種和無接種人群之間作染病比率的對比。
安全性和效用數據待公布
佩恩透露,他們把目標投向拉丁美洲、東歐、中東和東南亞等地區,一旦取得批準,就馬上對外公布試驗地點。
第三期臨床試驗預計需要1萬5000人。根據計算,一個國家冠病发病率若是1%,臨床試驗需要三個半月。佩恩指出,一些國家的發病率達到4%,試驗有望能以快四倍的時間進行,並在一個月內完成。一旦有了安全性和效用數據,公司會立即申請緊急批準。
公司已完成1000萬劑疫苗的生產,除了將用於第三期臨床試驗,也準備在獲得緊急批準後,馬上推出市場。
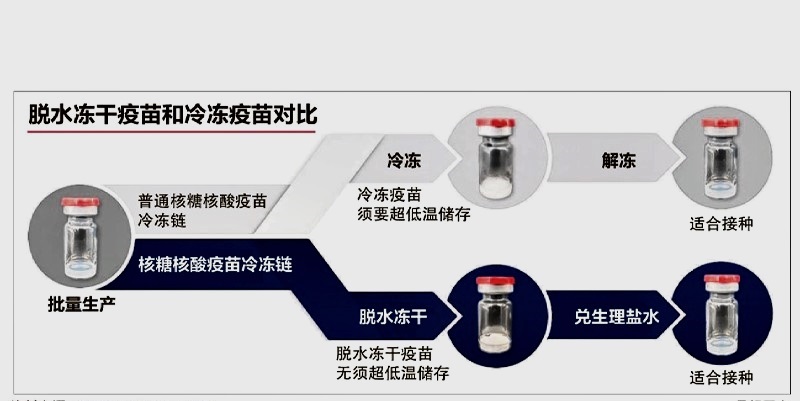
凍幹技術制成粉末狀態
這款疫苗以凍幹(lyophilised)技術制成粉末狀,無需低溫就能長期保存,接種時才兌生理鹽水,一瓶可以注射15至20劑。這樣一來,不但便於儲存和冷鏈運輸,也可大規模接種。
雖然疫苗研發落後於其他主要疫苗廠商9個月,但佩恩認為疫苗具有後發優勢,能根據現有疫苗的經驗和不足之處進行調整,包括只須要注射一劑。
他也說:“和其他疫苗相比,這款疫苗的聚乙二醇脂質保護層較少,也是唯一會在人體中自動降解的疫苗,因此不良反應相信會比其他疫苗少。”
雖然美國和新加坡預計能在年底之前完成疫苗接種工作,但佩恩也認為,世界上有許多國家仍需大量的疫苗供應,就算是在已經開始注射的國家,許多因過敏反應不適合接種其他疫苗的人也能使用。
至於那些使用滅活疫苗的國家,他也認為mRNA疫苗能提供更好的免疫保護。
文/圖:互聯網

光明網促請讀者及網民,共同維護言論自由精神,營造理性交流環境;任何人身攻擊、鼓吹種族與宗教仇恨、誹謗與造謠等留言,皆不代表本網站立場。 本網站有權刪除任何違反此原則的留言。